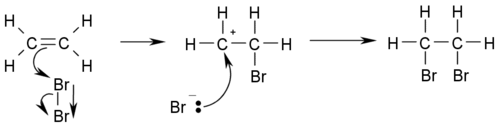
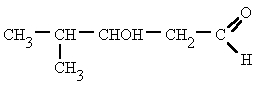Problemática ambiental mundial
Los problemas ambientales globales son aquellos que se han originado a causa del uso intensivo o alteración de los recursos naturales y cuya dimensión afecta de forma global al medio ambiente de nuestro planeta.

Calentamiento global
Qué es el Calentamiento Global?
El término Calentamiento Global se refiere al aumento gradual de las temperaturas de la atmósfera y océanos de la Tierra que se ha detectado en la actualidad, además de su continuo aumento que se proyecta a futuro.
Nadie pone en duda el aumento de la temperatura global, lo que todavía genera controversia es la fuente y razón de este aumento de la temperatura. Aún así, la mayor parte de la comunidad científica asegura que hay más que un 90% de certeza que el aumento se debe al aumento de las concentraciones de gases de efecto invernadero por las actividades humanas que incluyen deforestación y la quema de combustibles fósiles como el petróleo y el carbón. Estas conclusiones son avaladas por las academias de ciencia de la mayoría de los países industrializados.

Si se revisa el gráfico de las temperaturas de la superficie terrestre de los últimos 100 años, se observa un aumento de aproximadamente 0.8ºC, y que la mayor parte de este aumento ha sido en los últimos 30 años.
La proyecciones a partir de modelos de clima fueron resumidos en el Cuarto Reporte del IPCC (Panel Intergubernamental sobre Cambio Climático) en el 2007. Indican que la temperatura global probablemente seguirá aumentando durante el siglo XXI, el aumento sería de entre 1.1 y 2.9ºC en el escenario de emisiones más bajo y entre 2.4 y 6.4ºC en el de mayores emisiones.
Gases de efecto invernadero

El “efecto invernadero” es el calentamiento que se produce cuando ciertos gases de la atmósfera de la Tierra retienen el calor. Estos gases dejan pasar la luz pero mantienen el calor como las paredes de cristal de un invernadero.
En primer lugar, la luz solar brilla en la superficie terrestre, donde es absorbida y, a continuación, vuelve a la atmósfera en forma de calor. En la atmósfera, los gases de invernadero retienen parte de este calor y el resto se escapa al espacio. Cuantos más gases de invernadero, más calor es retenido.
Los niveles de gases de efecto invernadero (GEI) han aumentado y descendido durante la historia de la Tierra pero han sido bastante constantes durante los últimos miles de años. Las temperaturas medias globales se han mantenido bastante constantes también durante este periodo de tiempo hasta hace poco. A través de la combustión de combustibles fósiles y otras emisiones de GEI, los humanos están aumentando el efecto invernadero y calentando la Tierra.
Los científicos a menudo utilizan el término “cambio climático” en lugar de calentamiento global. Esto es porque, dado que la temperatura media de la Tierra aumenta, los vientos y las corrientes oceánicas mueven el calor alrededor del globo de modo que pueden enfriar algunas zonas, calentar otras y cambiar la cantidad de lluvia y de nieve que cae. Como resultado, el clima cambia de manera diferente en diferentes áreas.
- Aumento de la población mundial
- Quema de combustibles
- Destrucción de bosques
- Acciones antropicas
- Alteraciones de la radiación solar
- La mano del hombre
consecuencias
Temperaturas más cálidas
La acumulación de gases contaminantes hace que las temperaturas aumenten cada vez más y que los climas cambien: esto provoca sequías y, además, aumenta el riesgo de incendios que conllevan la deforestación y la desertización del planeta
Tormentas más intensas
El hecho de que las temperaturas sean más altas hace que las lluvias sean menos frecuentes, pero que sean más intensas; por tanto, el nivel de inundaciones y su gravedad también irán en aumento.
Propagación de enfermedades
Un cambio de temperatura de varios grados puede hacer que la zona templada se haga más acogedora a la propagación de determinadas enfermedades. De esta manera, pueden empezar a darse casos de mal de Chagas, el dengue u otras enfermedades que están olvidadas en los países desarrollados y en zonas que tradicionalmente han sido más frías.
Olas de calor más fuertes
El calentamiento global del planeta producido por la quema acelerada de combustibles fósiles agotables ha sido muy intenso en el Polo Norte. Esto hace que el Polo Norte esté hoy mucho más caliente que hace cincuenta años. La salud e incluso la vida de miles de personas pueden verse en riesgo debido al aumento de las olas de calor, tanto en lo que se refiere a frecuencia como a intensidad.
Derretimiento de los glaciares
Océanos con temperaturas más altas son océanos que derriten el hielo de los casquetes polares: esto significa que aumenta el nivel del mar.
Los efectos de alcance global incluirán cambios sustanciales en la disponibilidad de agua para beber y para riego, así como un aumento de los niveles del mar, cambios en los patrones de circulación del agua en los océanos, y la amenaza a la supervivencia de especies de flora y fauna que sobreviven en dichos ecosistemas.
Huracanes más peligrosos
El aumento de temperatura del mar hace que los huracanes se vuelvan más violentos. ¿Por qué? Pues porque un huracán es el medio que tiene el planeta para repartir el exceso de calor de las zonas cálidas a las más frías. Y a más temperatura, más huracanes, con todos los problemas que conllevan: destrucción de ciudades, de cultivos, desmantelamiento de todos los sistemas, enfermedades…
Cambio de los ecosistemas
Una temperatura más alta, menos precipitaciones, sequías e inundaciones hacen que el clima se adapte a esta nueva climatología y, por tanto, se produzcan cambios en la duración de las estaciones, aparezcan patrones más propios de climas monzónicos…
Aumento del nivel del mar
Como los casquetes se derriten, se vierte muchísima más agua en los mares y océanos y, por tanto, aumenta el nivel del mar: esta es una de las consecuencias del cambio climático más graves, ya que significa que muchísimas islas podrían desaparecer en el futuro y que un buen número de ciudades verán cómo su distancia a la costa se reduce de forma significativa.
Océanos con temperaturas más altas son océanos que derriten el hielo de los casquetes polares: esto significa que aumenta el nivel del mar.
Los efectos de alcance global incluirán cambios sustanciales en la disponibilidad de agua para beber y para riego, así como un aumento de los niveles del mar, cambios en los patrones de circulación del agua en los océanos, y la amenaza a la supervivencia de especies de flora y fauna que sobreviven en dichos ecosistemas.
Huracanes más peligrosos
El aumento de temperatura del mar hace que los huracanes se vuelvan más violentos. ¿Por qué? Pues porque un huracán es el medio que tiene el planeta para repartir el exceso de calor de las zonas cálidas a las más frías. Y a más temperatura, más huracanes, con todos los problemas que conllevan: destrucción de ciudades, de cultivos, desmantelamiento de todos los sistemas, enfermedades…
Cambio de los ecosistemas
Una temperatura más alta, menos precipitaciones, sequías e inundaciones hacen que el clima se adapte a esta nueva climatología y, por tanto, se produzcan cambios en la duración de las estaciones, aparezcan patrones más propios de climas monzónicos…
Aumento del nivel del mar
Como los casquetes se derriten, se vierte muchísima más agua en los mares y océanos y, por tanto, aumenta el nivel del mar: esta es una de las consecuencias del cambio climático más graves, ya que significa que muchísimas islas podrían desaparecer en el futuro y que un buen número de ciudades verán cómo su distancia a la costa se reduce de forma significativa.
soluciones
Estas son algunas de las soluciones que podemos llevar a cabo en nuestra vida cotidiana (que aunque a veces son insignificantes, si los hacemos todos constituirían un gran avance para solucionar este problema)
1.- Cambiar las bombillas tradicionales por las lámparas compactas fluorescentes (CFL). Las CFL, consumen 60menos electricidad que una bombilla tradicional, con lo que este simple cambio reducirá la emisión de 140 kilos de dióxido de carbono al año.
-2. Fijar el termostato a dos grados menos en invierno y dos grados más en verano. Ajustando la calefacción y el aire acondicionado se podrían ahorrar unos 900 kilos de dióxido de carbono al año.
- 3. Usar menos agua caliente. Se puede usar menos agua caliente instalando una ducha-teléfono de baja presión y lavando la ropa con agua fría o tibia.
-4. Utilizar un colgador en vez de la secadora de ropa. Si se seca la ropa al aire libre la mitad del año, se reduce en 320 kilos la emisión de dióxido de carbono al año
.- 5. Comprar productos de papel reciclado. La fabricación de papel reciclado consume entre 70% y 90% menos energía y evita que continúe la deforestación mundial.
- 6. Comprar alimentos frescos. Producir comida congelada consume 10 veces más energía
- 7. Comprar alimentos orgánicos. Los cultivos orgánicos absorben y almacenan mucho mas dióxido de carbono que los cultivos de las granjas "convencionales".
- 8. Evitar comprar productos que vengan en envases pesados. Si se reduce en un 10% la basura personal se puede ahorrar 540 kilos de dióxido de carbono al año.
- 9. Reciclar, se pueden ahorrar hasta 1000 kilos de residuos en un año reciclando la mitad de los residuos de una familia.
- 10. Elegir un automóvil de menor consumo. Al comprar un automóvil nuevo puede ahorrar 1.360 kilos de dióxido de carbono al año si este rinde dos kilómetros por litro de gasolina más que el otro. Es preferible que compre un automóvil híbrido o con biocombustibles.
11. Usar menos el auto. Prefiera caminar, andar en bicicleta, compartir el automóvil y usar el transporte público. Reduciendo el uso del automóvil en 15 kilómetros semanales evita emitir 230 kilos de dióxido de carbono al año.
-12. Revisar semanalmente los neumáticos. Inflar correctamente los neumáticos mejora la tasa de consumo de combustible en más del 3%. Cada litro de gasolina ahorrado evita la emisión de tres kilos de dióxido de carbono.
- 13. Plantar árboles. Una hectárea de árboles elimina, a lo largo de un año, la misma cantidad de dióxido de carbono que producen cuatro familias en ese mismo tiempo. Un solo árbol elimina una tonelada de dióxido de carbono a lo largo de su vida.
Estas son algunas de las soluciones que podemos llevar a cabo en nuestra vida cotidiana (que aunque a veces son insignificantes, si los hacemos todos constituirían un gran avance para solucionar este problema)
1.- Cambiar las bombillas tradicionales por las lámparas compactas fluorescentes (CFL). Las CFL, consumen 60menos electricidad que una bombilla tradicional, con lo que este simple cambio reducirá la emisión de 140 kilos de dióxido de carbono al año.
-2. Fijar el termostato a dos grados menos en invierno y dos grados más en verano. Ajustando la calefacción y el aire acondicionado se podrían ahorrar unos 900 kilos de dióxido de carbono al año.
- 3. Usar menos agua caliente. Se puede usar menos agua caliente instalando una ducha-teléfono de baja presión y lavando la ropa con agua fría o tibia.
-4. Utilizar un colgador en vez de la secadora de ropa. Si se seca la ropa al aire libre la mitad del año, se reduce en 320 kilos la emisión de dióxido de carbono al año
.- 5. Comprar productos de papel reciclado. La fabricación de papel reciclado consume entre 70% y 90% menos energía y evita que continúe la deforestación mundial.
- 6. Comprar alimentos frescos. Producir comida congelada consume 10 veces más energía
- 7. Comprar alimentos orgánicos. Los cultivos orgánicos absorben y almacenan mucho mas dióxido de carbono que los cultivos de las granjas "convencionales".
- 8. Evitar comprar productos que vengan en envases pesados. Si se reduce en un 10% la basura personal se puede ahorrar 540 kilos de dióxido de carbono al año.
- 9. Reciclar, se pueden ahorrar hasta 1000 kilos de residuos en un año reciclando la mitad de los residuos de una familia.
- 10. Elegir un automóvil de menor consumo. Al comprar un automóvil nuevo puede ahorrar 1.360 kilos de dióxido de carbono al año si este rinde dos kilómetros por litro de gasolina más que el otro. Es preferible que compre un automóvil híbrido o con biocombustibles.
11. Usar menos el auto. Prefiera caminar, andar en bicicleta, compartir el automóvil y usar el transporte público. Reduciendo el uso del automóvil en 15 kilómetros semanales evita emitir 230 kilos de dióxido de carbono al año.
-12. Revisar semanalmente los neumáticos. Inflar correctamente los neumáticos mejora la tasa de consumo de combustible en más del 3%. Cada litro de gasolina ahorrado evita la emisión de tres kilos de dióxido de carbono.
- 13. Plantar árboles. Una hectárea de árboles elimina, a lo largo de un año, la misma cantidad de dióxido de carbono que producen cuatro familias en ese mismo tiempo. Un solo árbol elimina una tonelada de dióxido de carbono a lo largo de su vida.